Η πρόσβαση σε καινοτόμες θεραπείες αποτελεί κρίσιμο παράγοντα για τη βελτίωση της ποιότητας ζωής των ασθενών. Ο Δείκτης W.A.I.T. (Waiting to Access Innovative Therapies) της Ευρωπαϊκής Ομοσπονδίας Φαρμακευτικών Βιομηχανιών (European Federation of Pharmaceutical Industries and Associations, EFPIA) χρησιμοποιείται ως ένα εργαλείο μέτρησης του ποσοστού και του χρόνου διαθεσιμότητας των νέων φαρμακευτικών προϊόντων.
Ουσιαστικά, ο σκοπός της χρήσης του είναι η συγκριτική επίδοση των χωρών της ΕΕ όσον αφορά το μέγεθος ασφαλιστικής κάλυψης των νέων φαρμακευτικών προϊόντων και την ταχύτητα ασφαλιστικής κάλυψης από τα ασφαλιστικά ταμεία. Το συνολικό δείγμα που εξετάζεται είναι τα νέα προϊόντα που εγκρίθηκαν μέσω της κεντρικής αξιολόγησης του Ευρωπαϊκού Οργανισμού Φαρμάκων (European Medicines Agency, EMA) την τελευταία τετραετία, ενώ ως εναρκτήριο σημείο αναφοράς ορίζεται ο μήνας έγκρισης τους από την Ευρωπαϊκή Επιτροπή (κατόπιν της θετικής γνωμοδότησης του EMA).
Στην τωρινή του μορφή ο Δείκτης W.A.I.T. δημοσιεύεται από το 2018 καλύπτοντας περισσότερες από 30 χώρες. Ένα τέτοιο εργαλείο θα μπορούσε να αποτελεί χρήσιμο εργαλείο συγκριτικής αξιολόγησης της πρόσβαση ασθενών σε νέα φάρμακα μεταξύ των χωρών, ειδικά αν καταρτιζόταν από ανεξάρτητο οργανισμό, με αντικειμενική, επιστημονικά τεκμηριωμένη μεθοδολογία, και με κοινώς αποδεκτά διασταυρωμένα στοιχεία. Παρόλα αυτά, υπάρχουν μια σειρά μεθοδολογικών θεμάτων που εγείρουν προβληματισμούς για την αξιοπιστία, την ποιότητα και – εν τέλει – την ερμηνεία των αποτελεσμάτων.
Αρχικά τα αποτελέσματά του δεν μπορούν να θεωρηθούν αυτόματα αξιόπιστα, χωρίς επιφυλάξεις, λόγω σημαντικών μεθοδολογικών περιορισμών που πηγάζουν σε διαφορές δεδομένων μεταξύ των χωρών. Άλλωστε, η συλλογή και η καταγραφή των στοιχείων για τον συγκεκριμένο δείκτης δεν προέρχεται από κάποιο ανεξάρτητο επιστημονικό οργανισμό αλλά γίνεται από την EFPIA που αποτελεί το θεσμικό όργανο εκπροσώπησης της φαρμακοβιομηχανίας στην Ευρώπη. Έπειτα από εσωτερική ανάλυση των στοιχείων που πραγματοποιήθηκε από το Υπουργείο Υγείας, διαπιστώσαμε τρία προβλήματα που θέτουν εν αμφιβόλω την χρησιμότητα και την ερμηνεία του συγκεκριμένου δείκτη.
Πρώτον, η ακρίβεια των δεδομένων φαίνεται να είναι αμφισβητήσιμη. H εσωτερική ανασκόπηση για τους δύο τελευταίους δείκτες W.A.I.T., που πραγματοποιήθηκε από τη Γενική Γραμματεία Στρατηγικού Σχεδιασμού του Υπουργείου Υγείας, αναδεικνύει το πρόβλημα. Συγκεκριμένα, η συνολική διαθεσιμότητα προϊόντων στην Ελλάδα έχει υποεκτιμηθεί: ο Δείκτης του 2024 αναφέρει ότι 75 προϊόντα είναι διαθέσιμα (σε σύνολο 173, έναντι 91 που είναι διαθέσιμα στη χώρα μας. Παράλληλα, το ποσοστό των προϊόντων με περιορισμένη διαθεσιμότητα είχε υπερεκτιμηθεί (41% αντί για 29%), καθώς επίσης το ποσοστό των αποζημιούμενων και πλήρως διαθέσιμων προϊόντων είχε υποεκτιμηθεί (59% αντί για 71%) (βλ. Γράφημα 1). Κατά συνέπεια, τα στοιχεία του δείκτη W.A.I.T. που δημοσιεύτηκαν πρόσφατα έχουν σημαντικά υπολογιστικά λάθη.
Δεύτερον, η διαθεσιμότητα εξαρτάται άμεσα από την απόφαση των Κάτοχων Άδειας Κυκλοφορίας (ΚΑΚ), δηλαδή των ιδίων των φαρμακευτικών εταιρειών, να κυκλοφορήσουν τα προϊόντα τους και των αναγκαίων ενεργειών τους. Για να αποζημιωθεί ένα προϊόν από τα κρατικά ασφαλιστικά ταμεία, οι εταιρείες πρέπει πρώτα να υποβάλουν φάκελο τιμολόγησης και αποζημίωσης στις αρμόδιες εθνικές αρχές, των οποίων η καθυστέρηση (ή η μη υποβολή) των φακέλων δεν αποτυπώνεται στις μετρήσεις. Άρα, κάποια προϊόντα δεν είναι διαθέσιμα, διότι οι ΚΑΚ επιλέγουν να μην προβούν στις απαραίτητες ενέργειες.
Τρίτον και σημαντικότερο, ο εν λόγω Δείκτης δεν εντοπίζει τα πολύτιμα (δηλαδή κλινικά ανώτερα ή οικονομικά αποδοτικά) προϊόντα για τα συστήματα υγείας τα οποία θα έρθουν να ικανοποιήσουν ακάλυπτες ιατρικές ανάγκες, αλλά περιλαμβάνει όλα τα νέα προϊόντα που έχουν εγκριθεί ανεξαιρέτως. Κατά αυτή την έννοια, δεν λαμβάνεται υπόψη η πραγματική προστιθέμενη αξία (σε σχέση με υπάρχουσες θεραπείες) για τους ασθενείς, τα συστήματα υγείας, και την κοινωνία. Μια τέτοια προσέγγιση αντιβαίνει τη διεθνή πρακτική και την επιστημονική βιβλιογραφία σχετικά με την αξιολόγηση και την πρόσβαση στην φαρμακευτική τεχνολογία. Το πρόβλημα εδώ πηγάζει από την πάγια θέση της βιομηχανίας να παρουσιάζει κάθε νέο φαρμακευτικό προϊόν αυτόματα και ως «καινοτόμο». Η επιδίωξη της πολιτείας πρέπει να είναι όχι απλώς οι πολίτες να έχουν πρόσβαση στη φαρμακευτική τεχνολογία, αλλά η πρόσβαση αυτή να είμαι πραγματικά ωφέλιμη για τον ασθενή.
Σε μια προσπάθεια αντιμετώπισης των παραπάνω προβλημάτων, με την ανάλυση των δεδομένων του Δείκτη 2024 για την Ελλάδα που δημοσιεύτηκε την περασμένη εβδομάδα, γίνεται εμφανές ότι το 53% των (108) προϊόντων που βρίσκονταν εκτός της Θετικής Λίστας, οφειλόταν σε απόφαση του ΚΑΚ (να μην τα κυκλοφορήσει ή να μην τα τιμολογήσει). Για τα (25) προϊόντα που είχαν λάβει άδεια και τιμή αλλά παρέμειναν εκτός θετικού καταλόγου αποζημίωσης, τα περισσότερα (16) δεν είχαν υποβάλει καν αίτηση ένταξης αποζημίωσης και 1 προϊόν είχε αποσύρει την αίτηση του (υπαιτιότητα ΚΑΚ), ενώ για 7 προϊόντα εκκρεμεί η τελική απόφαση τους. Για το υπολειπόμενο 1 προϊόν που υπήρξε αρνητική απόφαση αποζημίωσης, σημειώνεται πως δεν είχε καθόλου πρόσθετη κλινική αξία (βάσει των αξιολογήσεων της Γαλλικής Εθνικής Αρχής Υγείας, Haute Autorité de Santé).
Εδώ είναι σημαντικό να προστεθεί ότι από τα συνολικά 173 προϊόντα του δείγματος του Δείκτη 2024, μόνο 2 προϊόντα έχουν χαρακτηριστεί με μείζονα προστιθέμενη αξία, τα οποία και αποζημιώνονται ενώ μόνο 1 προϊόν από το σύνολο των προϊόντων με χαρακτηρισμό μέτριας προστιθέμενης κλινικής αξίας δεν αποζημιώνεται, για το οποίο όμως ο ΚΑΚ δεν έχει αιτηθεί ένταξη. Παρόμοια, αποζημιώνεται πληθώρα προϊόντων με χαρακτηρισμό μηδαμινού κλινικού οφέλους ή ακόμη και με ανεπαρκές κλινικό όφελος, τα οποία παρουσιάζονται στον Δείκτη ως «καινοτόμα».
Το γεγονός ότι με την πάροδο του χρόνου, ένα μεγαλύτερο ποσοστό νέων φαρμάκων συνοδεύεται από περιορισμένη διαθεσιμότητα μέσω της επιβολής περιορισμών αποζημίωσης, μπορεί να εξηγηθεί βάσει της αξίας αυτών των προϊόντων. Τα περισσότερα νέα φάρμακα εισέρχονται στην αγορά με συνεχώς υψηλότερες τιμές, ενώ η κλινική τους αξία δεν είναι πάντα σημαντικά ανώτερη από τις ήδη υπάρχουσες θεραπείες (όπως προκύπτει από τις δημοσιοποιημένες αξιολογήσεις των γαλλικών και γερμανικών οργανισμών αξιολόγησης τεχνολογιών υγείας). Ως αποτέλεσμα, τα Ευρωπαϊκά συστήματα υγείας και οι φορείς αποζημίωσης χρειάζεται να επιβάλλουν περισσότερους περιορισμούς πρόσβασης (π.χ. μόνο για σοβαρότερες περιπτώσεις ή ως θεραπείες δεύτερης και τρίτης γραμμής), ώστε να διασφαλιστεί το θετικό ισοζύγιο της αξίας τους με γνώμονα την μεγιστοποίηση της θεραπευτικής συνεισφοράς για τους υπάρχοντες πόρους τους. Με άλλα λόγια, η αυξημένη συχνότητα προϊόντων με περιορισμένη διαθεσιμότητα δεν αντανακλά μόνο μια πρόκληση των συστημάτων υγείας στην παροχή πρόσβασης νέων θεραπειών στους ασθενείς, αλλά και μια αδυναμία της φαρμακευτικής βιομηχανίας να προσφέρει πραγματικά καινοτόμα κλινικά προϊόντα που ικανοποιούν ακάλυπτες ιατρικές ανάγκες.
Στο Υπουργείο Υγείας εργαζόμαστε εντατικά, σχεδιάζοντας και υλοποιώντας στοχευμένες μεταρρυθμίσεις με στόχο την πρόσβαση των ασθενών σε νέες θεραπείες, την βελτίωση της υγείας των πολιτών, και τη διασφάλιση βιώσιμης χρηματοδότησης για τη φαρμακευτική φροντίδα. Παράλληλα, δουλεύουμε σε δράσεις για να καταστήσουμε το περιβάλλον πιο ελκυστικό στις φαρμακευτικές εταιρείες ώστε να διαθέτουν τα νέα τους προϊόντα στη χώρα, αυξάνοντας την αποδοτικότητα και την προβλεψιμότητα του συστήματος. Την ίδια στιγμή, όμως, χρειαζόμαστε μια δέσμευση από τη φαρμακοβιομηχανία να κυκλοφορεί τα προϊόντα που έχουμε ανάγκη – ένα ζήτημα που συζητείται αυτή την περίοδο στο πλαίσιο της αναθεώρησης της Ευρωπαϊκής Φαρμακευτικής Νομοθεσίας. Σε αυτή την προσπάθεια, επιδιώκουμε τη συνεργασία με τη φαρμακευτική βιομηχανία και την αξιοποίηση της πραγματικής καινοτομίας που συχνά φέρνει στην κλινική πρακτική. Ωστόσο, η χρήση και η αναπαραγωγή δεικτών που δεν αντικατοπτρίζουν την πολυπλοκότητα του θέματος και τις πραγματικές ανάγκες των ασθενών δεν συμβάλλει σε ένα γόνιμο δημόσιο διάλογο για ένα τόσο σημαντικό θέμα. Χρειάζεται ένα διάλογος με νηφαλιότητα, τεκμηρίωση και αίσθηση του ευρύτερου δημοσίου συμφέροντος. Το χρωστάμε, πρωτίστως, σε όλους τους συμπολίτες μας που δίνουν καθημερινά το δικό τους προσωπικό αγώνα για την υγεία τους.
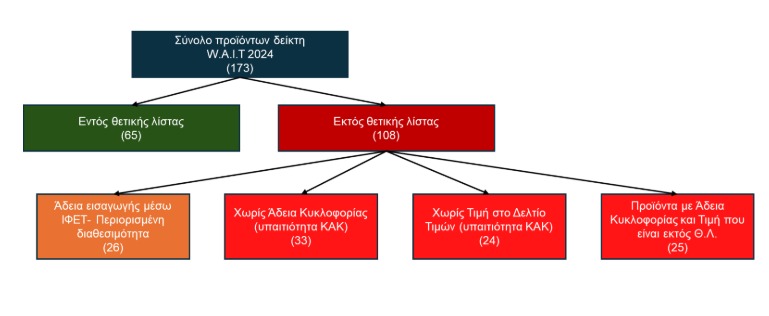
Γράφημα 1. Χαρτογράφηση πρόσβασης νέων φαρμακευτικών προϊόντων που εμπεριέχονται στο Δείκτη W.A.I.T. 2024 στην Ελληνική αγορά: Κατηγοριοποίηση Εντός Θετικής Λίστας και Εκτός Θετικής Λίστας, συμπεριλαμβανόμενης Περιορισμένης Διαθεσιμότητας
Ο Άρης Αγγελής, PhD, είναι Γενικός Γραμματέας Στρατηγικού Σχεδιασμού, Υπουργείο Υγείας, Visiting Associate Professor, London School of Hygiene & Tropical Medicine, Member Committee for Medicinal Products for Human Use, European Medicines Agency




